バイオテクノロジー分野では、細胞外小胞(EV)の研究と応用が、診断から治療用送達システムに至るまで幅広い可能性を秘めています。
EVは細胞から放出されるナノスケールの粒子で、タンパク質、RNA、核酸、脂質、代謝物など多様な分子を内包しています。EVの実用化に向けては、その精製と品質管理が極めて重要です。Timegated®ラマン分光法は、EVの製造や品質モニタリング、診断利用において多くの利点を提供します。
 フィンランド赤十字血液サービス研究所で働く科学者たちの様子。右側にいる博士研究員のHeikki Saari氏は、タイムゲーテッド・ラマンを用いた生物ナノ粒子の特性評価に関するプロジェクトに参加しています。
フィンランド赤十字血液サービス研究所で働く科学者たちの様子。右側にいる博士研究員のHeikki Saari氏は、タイムゲーテッド・ラマンを用いた生物ナノ粒子の特性評価に関するプロジェクトに参加しています。
細胞外小胞は、細胞間コミュニケーションにおいてさまざまな役割を果たすことが示されています。免疫応答の調節やがん転移といったプロセスに関与しており、EVを介した新しい細胞シグナル伝達メカニズムは、細胞生物学において現在大きな関心を集めています。
同時に、EVを診断(特にリキッドバイオプシー)や治療、ドラッグデリバリーに活用することへの関心も高まっています。多くの疾患では、EVの組成や量が変化するため、EVを早期診断ツールや予後予測指標として利用できる可能性があります。さらに、EVは幹細胞の治療ポテンシャルの多くを保持しており、複雑な疾患の治療にも活用できると期待されています。
原文の”Inline Raman Spectroscopy Provides Versatile Molecular Monitoring for Platelet Extracellular Vesicle Purification with Anion-Exchange Chromatography”は、こちらからご覧ください。
「EVは細胞、つまり生体から生じますが、それ自体が独立したナノ粒子です」
― フィンランド赤十字血液サービス R&Dマネージャー Saara Laitinen博士
関連資料:
”Inline Raman Spectroscopy Provides Versatile Molecular Monitoring for Platelet Extracellular Vesicle Purification with Anion-Exchange Chromatography”が 、 International Journal of Molecular Sciencesに掲載。
↑リンクからご覧ください。
Laitinen博士は、ビジネスフィンランドと13の組織が参加するコンソーシアムによって資金提供されている研究プロジェクト「EVE – Extracellular Vesicle Ecosystem for Theranostic Platforms」を主導しています。
EVの精製と収率向上に向けた課題
エクソソーム精製の課題として、高純度と高収率の両立があります。従来法の多くは、精製過程でEVの一部が失われます。
特に血液由来サンプルのように類似したリポタンパク粒子を含む複雑な混合物からEVを分離するのは困難です。伝統的なモニタリング手法は手間がかかり、複数の技術を必要とします。
私たちは品質保証や設定分析のために、製造サンプルの少なくとも10%を必要とします。この量を減らせれば、時間・資源・コストの節約になります。従来の試験は非常に労力がかかり、抗体や各種機器、サービス、コア施設を必要とします。私たちの目標は、これら手間のかかる分析工程を省くことです
― Laitinen博士
EV生産は通常の条件下では、一晩で行われますが、純度や収率などの特性分析を完了するまでにほぼ1週間かかります。
品質評価には、特定カーブの検出のための免疫ブロッティング、光散乱による粒径分布やナノ粒子濃度の測定、電子顕微鏡による形態観察など複数の方法を使いますが、どれもEV濃度を正確に測るには不十分です。
― 同博士
Timegatedラマン分光法は、分離プロセス中にリアルタイムで情報を提供できるため、モニタリングの高速化や詳細分析の必要性を軽減します。
Timegatedラマン分光法を使えば、例えば脂質ピークとの比較から不純物量を推定し、それをEV濃度に換算できます。つまり1回の測定で多くの情報が得られるのです。
― 同博士
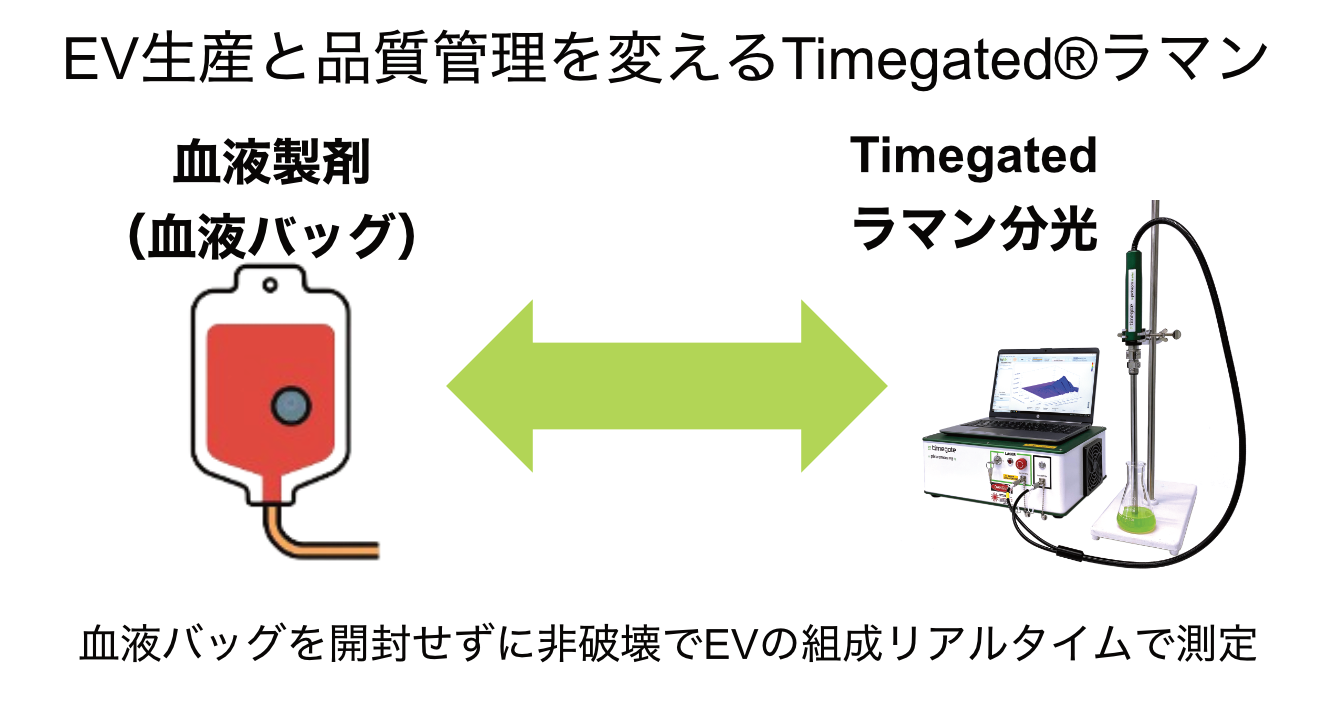
血液バッグおよびEV治療製剤のモニタリング
Timegatedラマン分光法は、EV研究や製造において迅速かつ非破壊的に分子組成の情報を得る手段となります。ラマンスペクトルを解析することで、サンプルを破壊せずにEVの組成や品質を評価できるため、製造工程全体でのモニタリングや品質管理に適しています。
複数の工程を管理する必要がありますが、Timegatedラマンはそのための解決策となり得ます。従来法より少ないサンプル量で、工程から独立して測定でき、血液バッグに触れずに分子組成の変化を観察できます。
― Laitinen博士
フィンランド赤十字血液サービスは、「生物ナノ粒子の特性評価のための新しいラマン分光法」という6か月間のプロジェクトを申請しています。このプロジェクトはフィンランド科学アカデミーとGeneCellNanoフラッグシップの資金提供を受け、Timegated® Raman分光計「PicoRaman M3」を用いてEV測定を行います。
このアプローチでは、ラマンクロマトグラフィーを用いてサンプルフローや品質をインラインで監視します。
― Laitinen博士
FPLC(高速タンパク質液体クロマトグラフィー)システムに検出器を接続してエクソソーム精製をモニタリングする初期試験では、有望なスペクトルデータが得られました。目的は、保存・輸送・その他の工程で製品組成を壊さずに品質シグナルを監視することです。
単にチューブで装置と検出器をつなぐだけで動作しました。初回でもかなり良いスペクトルデータが得られたと感じています。
― Heikki Saari博士研究員
研究チームは、血液バッグやEV治療製剤の品質管理にラマン分光法を応用する方法を探っています。非破壊・高スループットの測定により、工程中の品質シグナルや特定イベントを特定することを目指しています。
サンプルを壊さず、操作も不要で、プラスチックバッグ越しに測定できる。タイムゲーテッド・ラマンの初期結果は有望です
― Laitinen博士
その後の測定では、特にリポタンパク質が明瞭に検出できることが確認されました。
測定は迅速で、S/N比も良好でした。この分光計はEVサンプル間の生化学的な違いを明確に示すことができます。
― Timegate Instruments シニアアプリケーションスペシャリスト Dr. Jacopo Zini
研究、治療、医薬品のためのEV
フィンランド血液サービスでは、年間平均18万5,000件の全血献血を受け入れ、それを赤血球や血小板などの臨床グレード製品に分画しています。
私たちの使命は、命を救う機会を創り出すことです。そのために、命に関わる疾患に対する新しい治療法の研究に取り組んでいます
― Saara Laitinen博士
現在、同機関のEVストックは研究目的のみに使用されており、診断から健康状態のモニタリングまで幅広く活用されています。
私たちはフィンランドの医療において中心的な役割を担っているため、将来的にはEVを治療やドラッグデリバリーに利用するためのプラットフォーム構築も検討しています。
― Saara Laitinen博士
特に、赤血球由来のEVプラットフォームを開発中で、純粋な赤血球を分離し、ナノエリスロソームと呼ばれるEV様構造に変換します。これらは低分子化合物、酵素、RNAなどを搭載可能で、EV表面のターゲティング分子を改変することで治療効果の向上を目指しています。
EVはさまざまな“構成”を持つ物語のようなもので、そこから多くの情報が読み取れます。既に臨床用途に使われている複数の細胞タイプがありますが、EVは次世代の治療法として大きな注目を集めています。ただし、これらの細胞を製造する際の品質保証と管理には課題があります
― Saara Laitinen博士
赤血球、血小板、有核細胞、免疫細胞など、異なる種類の細胞がさまざまな用途に使われています。新規治療法では、どの細胞が患者に適しているかを特定することが重要です。
特に免疫細胞は、組織適合性検査(ティッシュタイピング)が必要なため、単純に分離して全患者に投与できるわけではありません。こうした多様な細胞製品にもモニタリング手段が求められます。
もしラマン信号を使って、他の分析から得られる特定のパラメータと信号を相関できれば、それは大きな成果になります。これにより、手作業によるサンプル採取を省きつつ、必要な情報を得られます
―Saara Laitinen博士
まずは赤血球と血小板からEVを大量生産することを計画していますが、将来的には免疫細胞を含むあらゆる血液細胞からの生産も視野に入れています。最終的には、細胞工場で作られた特定のターゲット分子を持つEVを、患者治療に直接用いることも可能になるかもしれません。さらに、異なるラベルを付けたEVをナノスケールデバイスの基準材料として臨床フローサイトメトリーや品質管理に活用する構想もあります。
EV市場の拡大
新型コロナウイルス感染症(COVID-19)とRNAワクチンの登場により、立法当局は新薬開発の進行速度を再評価せざるを得なくなりました。
特に生細胞細胞を用いる分野では、新薬の開発にあまりにも時間がかかりすぎていました。企業はそれほど長くは持ちこたえられません。この分野は進化の途上であり、多くの要素が市場の成長に影響を与えます
― Saara Laitinen博士
世界の血液事業の視点から見たもう一つの重要課題は、新たな輸血感染ウイルスや微生物の監視です。
現在、すべての献血に対して一定の定期検査を行い、潜在的な脅威を慎重に監視しています。未知のウイルスについては、血流内に存在することを極めて早期に検出できる、十分に感度の高いモニタリングツールが望まれます
― Saara Laitinen博士
数年前まで、EVは「生きた細胞に由来するため、従来の医薬品や化合物とは異なる」として、その性質の特定が議論の的でした。
EVは核を持たないため、先進医療製品(ATMP)の細胞そのものより安全と考えられますが、単純な話ではありません。まず優先されるのは安全性、次に有効性です。生きた細胞由来の成分が組織や血液、さらには異種間で適合するかどうかを最初に確認しなければなりません。
この分野は規制や法律が1〜2歩遅れて進むのが当然で、国や地域ごとに進展スピードも異なります
―Saara Laitinen博士
Grand View Researchによると、世界のエクソソーム市場は2022年に1億1,225万米ドルと評価され、2030年には年間平均成長率(CAGR)32.75%で10億3,000万米ドルに達すると予測されています。
この10年間、EV市場規模の予測はやや過熱気味でした。特に臨床用途における結果の時期を予測するのは依然として非常にリスクがあります。しかし、特許出願や論文発表数は過去5年間で指数関数的に増加しています
― Saara Laitinen博士
EV市場予測を難しくしているのは、EVの多様性と、その由来ごとの純度確保の難しさです。
薬理学的に安全な方法でどれだけ製造できるかが最大の課題です。そのため、薬理学的品質と組成の品質に焦点が置かれ、収率や純度など製造・精製・濃縮の問題が極めて重要となります。EVの科学的理解はまだ初期段階にあります
― Saara Laitinen博士
治療で世界的課題に挑む
最近、EV分析において新たに重要視されているのは機能性の評価です。
治療法を開発する際には、特性だけでなく機能性も調べる必要があります。
試験管内(in vitro)では構成要素がそろっていても、実際には機能しない場合があります。これはEVの製造や精製、保存、輸送、再利用方法と密接に関係しており、元の機能が保持されているかを確認しなければなりません
― Saara Laitinen博士
治療用にEVを大量製造するには、サンプルを大量消費しない品質管理システムが不可欠です。
その意味で、他の分析はサンプル消費を抑えた方法で行う必要があります。タイムゲーテッド・ラマンは、例えば脂質プロファイリング診断のための血液パネル研究で、追加分析が必要なサンプル数を減らすことに役立つ可能性があります。
EVは多次元的な構成を持つため、研究自体も容易ではありません。
私はEV分野には、当初の遺伝子治療以上の可能性があると見ています。課題とチャンスは表裏一体です。一つのプールにさえ複数の種類のEVが含まれ、異なる細胞タイプ由来のさまざまなEVがあります。EVはそのままでも、また改良・搭載・修飾しても利用できます。EVから学べることは多いのです
― Saara Laitinen博士
現在、フィンランド血液サービスでは、EV生産用に週あたり最大4製品の血小板濃縮液を確保できると見積もっています。1つの濃縮液からは数十億個のEVが得られます。
1つの濃縮液から複数の製品が得られ、それらはすべてR&D目的で科学者を支援します。価格は可能な限り低く抑え、研究者の利用しやすさを確保します。私たちの目標は、手頃な価格で高品質な製品を提供し、この分野の発展を加速させることです。将来的には、命を救う治療機器の開発にもつながるでしょう
― Saara Laitinen博士
関連資料:”Inline Raman Spectroscopy Provides Versatile Molecular Monitoring for Platelet Extracellular Vesicle Purification with Anion-Exchange Chromatography”が 、 International Journal of Molecular Sciencesに掲載。
↑リンクから論文をご覧ください。
関連資料:Timegateラマン法によるEV(細胞外小胞)解析 — 細胞外小胞の中の見えないものを捉える
▶︎ Timegated®テクノロジーの詳細はこちらをご覧ください。
詳細については、ウェブサイトもご参照ください。